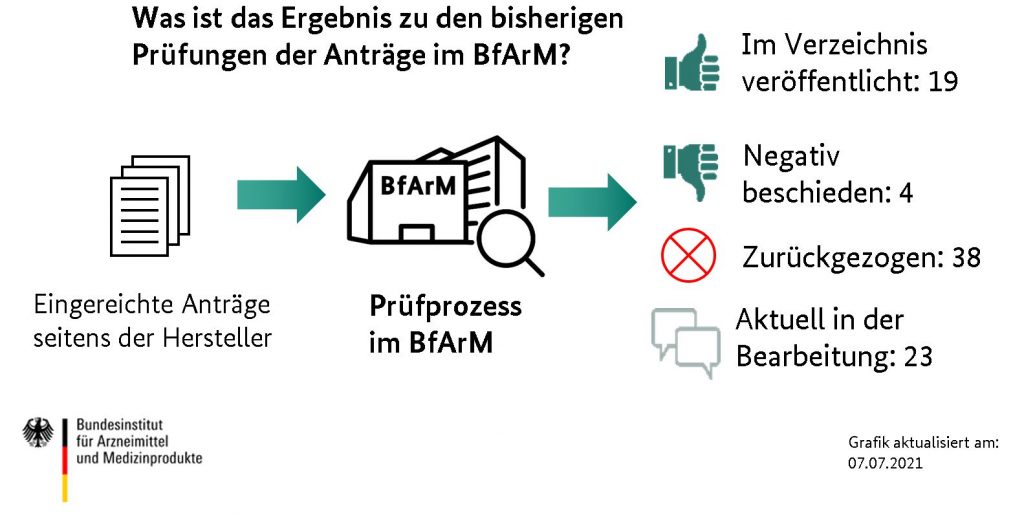
Die praktische Umsetzung der MDR-Anforderungen beherrscht die Medizintechnikbranche nicht erst seit dem 26. Mai 2021. Dennoch sind noch immer nicht alle Voraussetzungen durch die Behörden und die beteiligten Akteure umgesetzt worden. Der Verband der Elektrotechnik Elektronik Informationstechnik e.V. (VDE) hat in einem Artikel die offenen Punkte zusammengefasst:
- Benannte Stellen: Aktuell sind 22 benannte Stellen entsprechend der MDR zertifiziert, jedoch nicht alle bilden das gesamte fachliche Spektrum ab.
- Rechtsakte: Aktuell sind 3 von 50 Rechtsakten erlassen, welche die einzelnen Bestimmungen der MDR detaillierter regeln sollen.
- Harmonisierte Normen: Aktuell gibt es 5 harmonisierte Normen, die bei der Umsetzung der grundlegenden Sicherheits- und Leistungsanforderungen der MDR helfen sollen.
- Leitfäden: Die Koordinierungsgruppe für Medizinprodukte (MDCG) soll die MDR erklären und auslegen. Dafür werden fortlaufende MDCG-Leitfäden veröffentlicht.
- EUDAMED: Die europäische Medizinproduktedatenbank EUDAMED ist weiterhin nicht vollumfänglich verfügbar. Dies führt weiterhin zu erheblichen Verzögerungen und zum Teil zu Mehraufwänden.
Der durch die Vielzahl an Gesetzen, Regeln und Empfehlungen entstehende Dokumentationsaufwand wird vor allem für Klein- und mittelständische Unternehmen enorme Belastungen nach sich ziehen. Der personelle und finanzielle Mehraufwand wird für manche Firmen nicht zu stemmen sein und die betroffenen Medizinprodukte werden zwangsläufig vom Markt verschwinden.